肺癌是全球首要的逝世原因之一,依据世卫安排的数据,2018年约有209万肺癌新发病例,一起肺癌也是我国癌症相关逝世的根本原因[1]。
在曩昔的十年中,免疫医治被认为是肺癌医治中最重要的打破之一。免疫肿瘤学(I-O, Immuno-Oncology)可分为三类:(1)自动免疫:疫苗、细胞因子和检查点按捺剂;(2)被迫免疫:靶向单克隆抗体等;(3)混合免疫:自动和被迫相结合的办法。其间,免疫检查点,特别是PD-1/PD-L1轴被认为是最有期望的靶点。PD-1/PD-L1轴按捺剂对肺癌患者的预后有重要影响,然后成为肺癌二线医治的首选。各种临床研讨进一步探求了PD-1/PD-L1轴按捺剂与化疗的联合运用,促使其成为部分肺癌的一线医治首选,并敏捷改变了肺癌的医治形式。
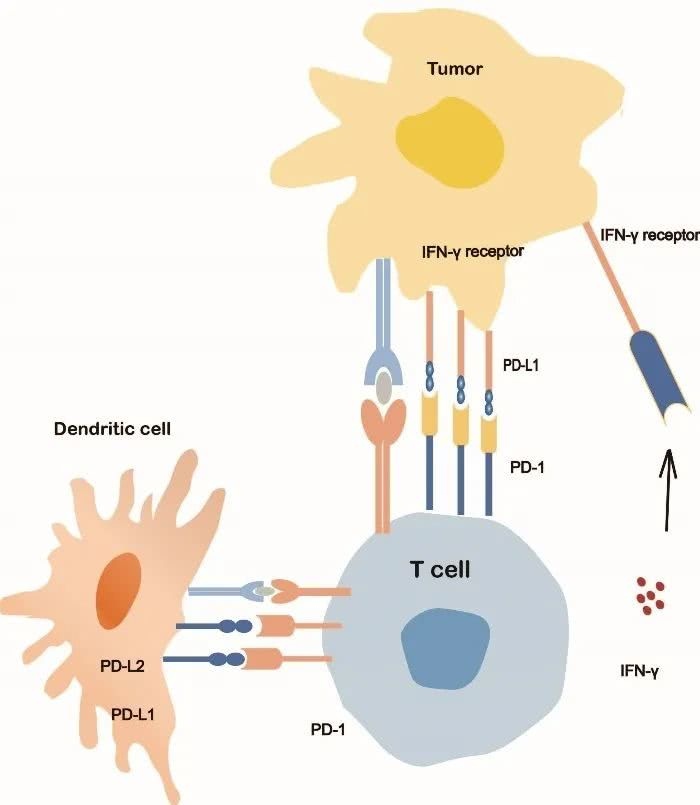
PD-1是CD28宗族的一员,在多种免疫细胞中表达,特别是外周安排中活化的CD8+T细胞、CD4+T细胞和B细胞中[2]。PD-1有两个结合配体,PD-L1(B7-H1或CD274)和PDL2(B7-DC或CD273)。PD-L1表达于活化的T细胞、B细胞、巨噬细胞、树突状细胞和癌细胞,PD-L2的表达有限,首要表达于活化的巨噬细胞、树突状细胞和少数肿瘤细胞。PD-1/PD-L1结合按捺了细胞毒性T淋巴细胞的增殖和存活,诱导浸润性T细胞凋亡,且削减细胞因子的发生[3,4]。PD-L1在27%到57%的NSCLC患者中表达[5],PD-1/PD-L1通路在肿瘤细胞的免疫逃逸中起及其重要的效果[6,7]。肿瘤细胞经过上调PD-L1来按捺T细胞的活动,然后躲避免疫反响。PD-1或PD-L1按捺剂经过阻断按捺的T细胞信号,从头激活CD8+T细胞的抗肿瘤活性[8]。根据这一布景,许多针对PD-1途径的药物正在开发中,并进行了临床试验。现在美国FDA已同意Nivolumab、Pembrolizumab(PD-1按捺剂)、Atezolizumab、Avelumab和Durvalumab(PD-L1按捺剂)应用于肿瘤的临床医治。但是,哪些患者获益最多、怎么辨认存在原始或获得性耐药危险的患者,还没有彻底确认。
PD-1/PD-L1信号通路机制图
肿瘤微环境扑朔迷离,各种免疫进程相互影响,使肺癌的免疫疗法在临床转化中面对许多问题。例如,只要20%-25%的非小细胞肺癌患者对免疫按捺剂表现出可继续的反响[9],而影响免疫按捺剂临床效果的要素也是多方面的,确认牢靠免疫按捺剂的临床或生物标志物是其间的重要一环。PD-L1是FDA同意的第一个免疫检查点按捺剂的生物标志物,但是在肿瘤不表达PD-L1的患者中能够发现PD-1/PD-L1按捺剂的临床好处;反之,许多肿瘤高度表达PD-L1的患者不能获益于PD-1/PD-L1按捺剂。更多更有用的生物标志物需要被探求,以便筛选出最适合免疫医治的方针人群。本文也对此作了总结和剖析,包含肺癌患者中肿瘤骤变负荷(TMB)、特异性基因骤变,乃至肠道微生物群等关于免疫检查点按捺剂反响的相关。
参考文献
[1] W. Chen, R. Zheng, H. Zeng, S. Zhang, Epidemiology of lung cancer in China, Thoracic cancer, 6 (2015) 209-215.
[2] Y. Agata, A. Kawasaki, H. Nishimura, Y. Ishida, T. Tsubata, H. Yagita, T. Honjo, expression of the PD-1 antigen on the surface of stimulated mouse T and B lymphocytes, Int Immunol, 8 (1996) 765-772.
[3] K. Karwacz, C. Bricogne, D. MacDonald, F. Arce, C.L. Bennett, M. Collins, D. Escors, PD-L1 co-stimulation contributes to ligand-induced T cell receptor down-modulation on CD8+ T cells, EMBO Mol Med, 3 (2011) 581-592.
[4] D.M. Pardoll, The blockade of immune checkpoints in cancer immunotherapy, Nat Rev Cancer, 12 (2012) 252-264.
[5] Y.B. Chen, C.Y. Mu, J.A. Huang, Clinical significance of programmed death-1 ligand-1 expression in patients with non-small cell lung cancer: a 5-year-follow-up study, Tumori, 98 (2012) 751-755.
[6] Y. Iwai, M. Ishida, Y. Tanaka, T. Okazaki, T. Honjo, N. Minato, Involvement of PD-L1 on tumor cells in the escape from host immune system and tumor immunotherapy by PD-L1 blockade, Proc Natl Acad Sci U S A, 99 (2002) 12293-12297.
[7] J.M. Taube, R.A. Anders, G.D. Young, H. Xu, R. Sharma, T.L. McMiller, S. Chen, A.P. Klein, D.M. Pardoll, S.L. Topalian, L. Chen, Colocalization of inflammatory response with B7-h1 expression in human melanocytic lesions supports an adaptive resistance mechanism of immune escape, Sci Transl Med, 4 (2012) 127ra37.
[8] E.B. Garon, N.A. Rizvi, R. Hui, N. Leighl, A.S. Balmanoukian, J.P. Eder, A. Patnaik, C. Aggarwal, M. Gubens, L. Horn, E. Carcereny, M.J. Ahn, E. Felip, J.S. Lee, M.D. Hellmann, O. Hamid, J.W. Goldman, J.C. Soria, M. Dolled-Filhart, R.Z. Rutledge, J. Zhang, J.K. Lunceford, R. Rangwala, G.M. Lubiniecki, C. Roach, K. Emancipator, L. Gandhi, K.-. Investigators, Pembrolizumab for the treatment of non-small-cell lung cancer, N Engl J Med, 372 (2015) 2018-2028.
[9] C. Kaderbha , Z. Tharin, F. Ghiringhelli, The Role of Molecular Profiling to Predict the Response to Immune Checkpoint Inhibitors in Lung Cancer, Cancers, 11 (2019).



